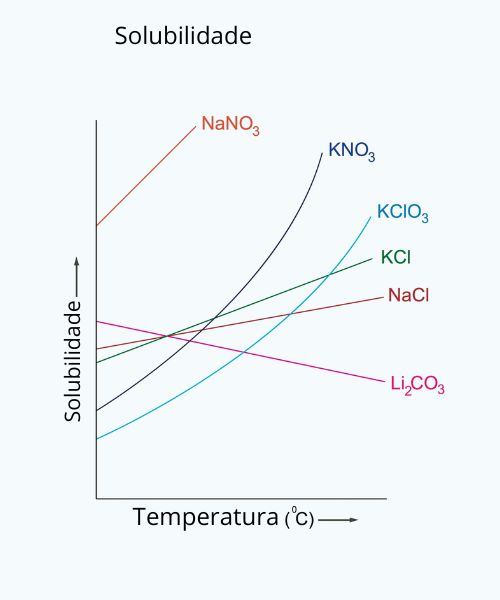
A temperatura afeta a solubilidade de diferentes maneiras:
para a maioria dos sólidos, a solubilidade aumenta com o aumento da temperatura, pois o calor fornece mais energia cinética para quebrar as ligações do soluto. No entanto, para os gases, a solubilidade diminui com o aumento da temperatura, pois eles possuem mais energia cinética e escapam do líquido. A dissolução de alguns sólidos pode se tornar menos solúvel com o aumento da temperatura, se o processo de dissolução for exotérmico.
Solubilidade de sólidos
Aumento da solubilidade: Na maioria dos casos (processo de dissolução endotérmico), um aumento na temperatura aumenta a solubilidade do soluto sólido. A energia extra ajuda a quebrar as forças que mantêm as partículas do soluto unidas.
Diminuição da solubilidade: Alguns sólidos, como o sulfato de cério (III), tornam-se menos solúveis à medida que a temperatura aumenta (processo exotérmico).
Exceção: Substâncias hidratadas podem ter sua solubilidade aumentada até um certo ponto, quando começam a desidratar.
Solubilidade de gases
Diminuição da solubilidade: A solubilidade dos gases em líquidos diminui com o aumento da temperatura.
Por quê? O aumento da temperatura aumenta a energia cinética das moléculas de gás, fazendo com que elas se tornem mais propensas a escapar da fase líquida e voltar para a fase gasosa.
Exemplo: Refrigerantes perdem o gás mais rapidamente quando estão quentes porque a solubilidade do dióxido de carbono é menor em temperaturas elevadas.
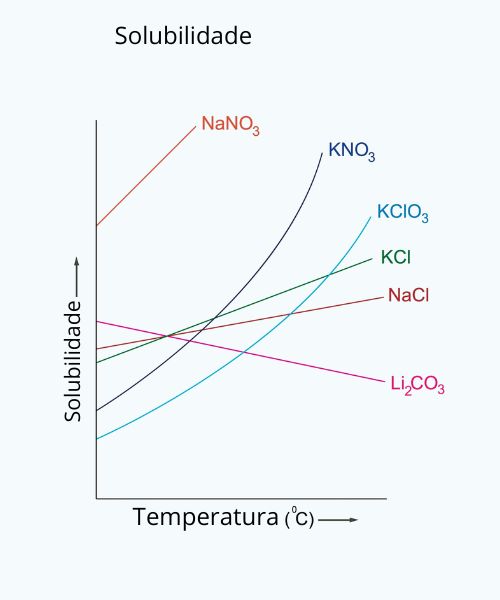
A solubilidade pode ser afetada pela temperatura?
Sim, a temperatura afeta diretamente a solubilidade. Para a maioria dos sólidos em líquidos, um aumento na temperatura aumenta a solubilidade, mas para gases em líquidos, o efeito é o oposto: a solubilidade diminui conforme a temperatura aumenta.
Efeitos da temperatura na solubilidade:
Sólidos em líquidos:
Geralmente aumenta: A maioria dos sólidos se torna mais solúvel com o aumento da temperatura. Isso ocorre porque o calor fornece mais energia para quebrar as forças intermoleculares entre o soluto e o solvente.
Exceções: Algumas substâncias, como as hidratadas, podem ter sua solubilidade aumentada até um certo ponto e depois diminuir ao aumentar a temperatura. A solubilidade de substâncias como o sal de cozinha (NaCl) é menos afetada por pequenas variações de temperatura.
Gases em líquidos:
Diminui: Gases se tornam menos solúveis em líquidos quando a temperatura aumenta. O calor dá mais energia às moléculas de gás, fazendo com que elas escapem mais facilmente da solução, como acontece com um refrigerante “quente” que perde o gás mais rápido, diz o Brasil Escola.
Líquidos em líquidos:
A solubilidade pode aumentar ou diminuir dependendo das interações entre os dois líquidos.
Processos de dissolução:
Endotérmico: Se a dissolução absorve calor, a solubilidade aumenta com o aumento da temperatura.
Exotérmico: Se a dissolução libera calor, a solubilidade diminui com o aumento da temperatura.
Geralmente aumenta: A maioria dos sólidos se torna mais solúvel com o aumento da temperatura. Isso ocorre porque o calor fornece mais energia para quebrar as forças intermoleculares entre o soluto e o solvente.
Exceções: Algumas substâncias, como as hidratadas, podem ter sua solubilidade aumentada até um certo ponto e depois diminuir ao aumentar a temperatura. A solubilidade de substâncias como o sal de cozinha (NaCl) é menos afetada por pequenas variações de temperatura.
Diminui: Gases se tornam menos solúveis em líquidos quando a temperatura aumenta. O calor dá mais energia às moléculas de gás, fazendo com que elas escapem mais facilmente da solução, como acontece com um refrigerante “quente” que perde o gás mais rápido, diz o Brasil Escola.
A solubilidade pode aumentar ou diminuir dependendo das interações entre os dois líquidos.
Endotérmico: Se a dissolução absorve calor, a solubilidade aumenta com o aumento da temperatura.
Exotérmico: Se a dissolução libera calor, a solubilidade diminui com o aumento da temperatura.
Quais fatores podem afetar a solubilidade das substâncias?
A solubilidade das substâncias é afetada por temperatura, pressão e a natureza química do soluto e do solvente. Geralmente, a solubilidade de sólidos aumenta com o aumento da temperatura, enquanto a de gases diminui. A pressão afeta principalmente gases, aumentando a solubilidade com o aumento da pressão, de acordo com a Lei de Henry. A regra de que “semelhante dissolve semelhante” resume a influência da polaridade: substâncias polares dissolvem-se em solventes polares e substâncias apolares em solventes apolares.
Fatores que afetam a solubilidade
OH NH2
Para a maioria dos sólidos: a solubilidade aumenta com o aumento da temperatura, pois isso fornece mais energia para quebrar as ligações no soluto e solvente.
Para gases: a solubilidade diminui com o aumento da temperatura. O aumento da temperatura dá às moléculas de gás mais energia para escapar do solvente líquido.
Para gases: a pressão tem um impacto significativo. A solubilidade de um gás em um líquido é diretamente proporcional à pressão do gás acima do líquido (Lei de Henry).
Para sólidos e líquidos: a pressão tem pouca influência.
OH NH2
Em compostos orgânicos, a presença de cadeias de hidrocarbonetos longas e apolares diminui a solubilidade em água.
Qual a influência da temperatura na solubilidade das proteínas?
A temperatura afeta a solubilidade das proteínas de duas maneiras principais:
um aumento moderado da temperatura pode aumentar a solubilidade de algumas proteínas, enquanto temperaturas mais altas levam à desnaturação e à consequente precipitação (diminuição da solubilidade). Esse efeito depende da natureza do processo de dissolução: se for endotérmico, a solubilidade aumenta com o calor; se for exotérmico, a solubilidade diminui.
Efeito da temperatura na solubilidade das proteínas
0∘C
Como a temperatura afeta a solubilidade dos gases em líquidos?
A temperatura tem uma relação inversa com a solubilidade de gases em líquidos: quanto maior a temperatura, menor a solubilidade. Isso acontece porque o aumento da temperatura aumenta a energia cinética das moléculas de gás, permitindo que elas escapem mais facilmente do líquido.
Explicação detalhada
CO2