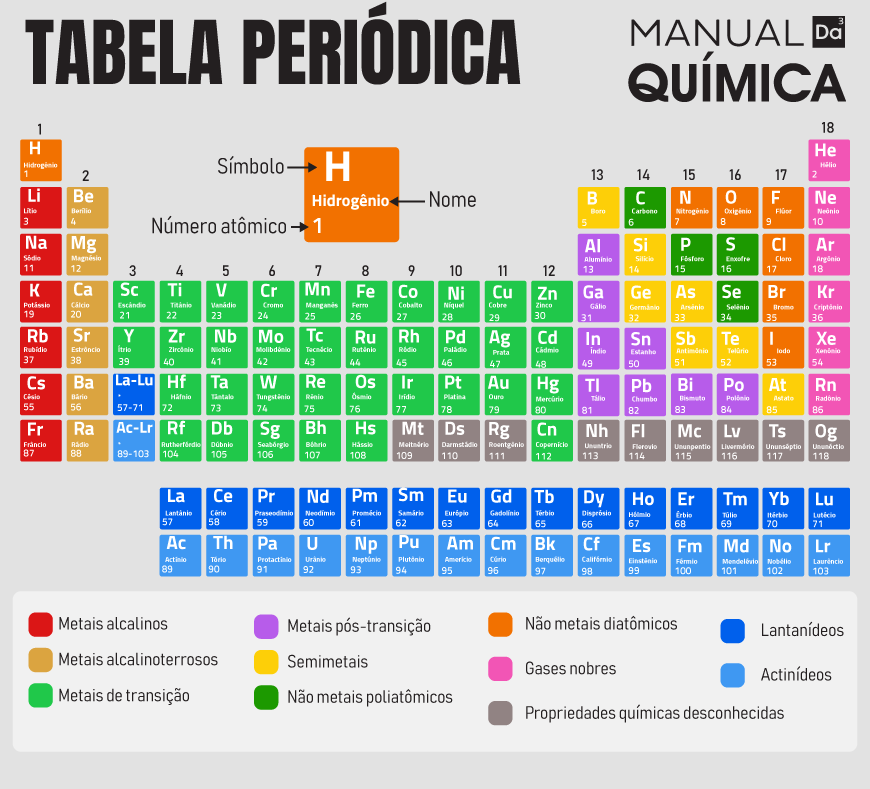
A tabela periódica é dividida em períodos (linhas horizontais) e grupos ou famílias (colunas verticais). Os elementos são organizados em ordem crescente de número atômico, sendo que os períodos indicam o número de camadas eletrônicas e os grupos contêm elementos com propriedades químicas semelhantes.
Períodos
São as sete linhas horizontais da tabela.
Os elementos em um mesmo período têm a mesma quantidade de camadas eletrônicas.
Quanto mais abaixo um elemento está na tabela, mais camadas eletrônicas ele possui.
Grupos (ou Famílias)
São as 18 colunas verticais.
Os elementos em um mesmo grupo têm propriedades químicas semelhantes e o mesmo número de elétrons na camada de valência.
Um exemplo é o Grupo 18, dos gases nobres, que são pouco reativos.
Outras divisões
Blocos: A tabela também é dividida em quatro blocos (s, p, d e f) com base na sua configuração eletrônica.
Classificação de elementos: Os elementos são classificados em metais, não metais e semimetais, com base em suas propriedades físicas e químicas.
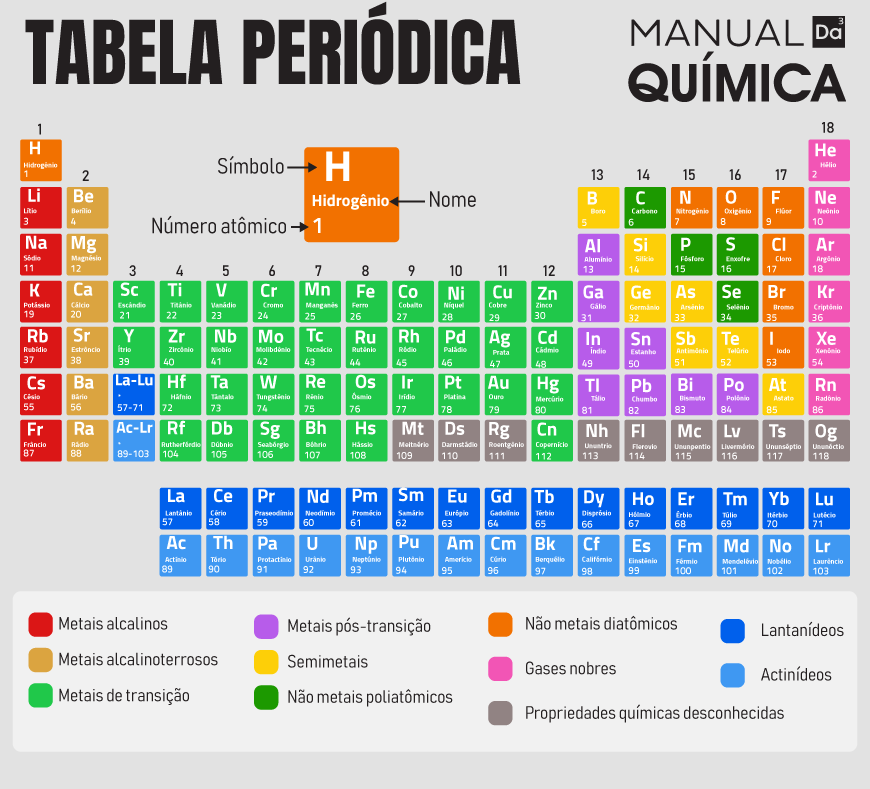
Como são divididos os períodos da tabela periódica?
Os períodos da tabela periódica são as linhas horizontais (7 no total) e correspondem ao número de níveis de energia dos átomos. Cada período representa uma nova camada de elétrons, e ao avançar para o próximo período, os elementos ganham mais um nível de energia.
Organização: As linhas horizontais são os períodos, e as colunas verticais são os grupos ou famílias.
Número de níveis: O número do período indica a quantidade de níveis de energia que os elétrons do átomo ocupam. Por exemplo, um elemento no 2º período tem seus elétrons distribuídos em dois níveis de energia, enquanto um no 3º período os tem em três níveis.
Número de elementos: Cada período tem um número específico de elementos:
1º Período: 2 elementos
2º Período: 8 elementos
3º Período: 8 elementos
4º Período: 18 elementos
5º Período: 18 elementos
6º e 7º Períodos: 32 elementos cada
1º Período: 2 elementos
2º Período: 8 elementos
3º Período: 8 elementos
4º Período: 18 elementos
5º Período: 18 elementos
6º e 7º Períodos: 32 elementos cada
Como dividir os elementos da tabela periódica?
s,p,d,f
Divisões principais
Períodos: São as 7 linhas horizontais da tabela, organizadas em ordem crescente de número atômico. Cada período corresponde a um nível de energia eletrônica (camada eletrônica).
Grupos ou Famílias: São as 18 colunas verticais, que agrupam elementos com propriedades químicas similares. Eles são numerados de 1 a 18, ou divididos em duas famílias maiores:
Família A (elementos representativos): Grupos de 1A a 8A (ou 1, 2 e 13-18).
Família B (elementos de transição): Grupos de 3B a 12B (ou 3-12).
Família A (elementos representativos): Grupos de 1A a 8A (ou 1, 2 e 13-18).
Família B (elementos de transição): Grupos de 3B a 12B (ou 3-12).
Outras divisões
s,p,d,f
Como a tabela periódica está organizada?
A tabela periódica está organizada em 7 períodos (linhas horizontais) e 18 grupos ou famílias (colunas verticais), ordenando os elementos em ordem crescente de número atômico (número de prótons). Elementos no mesmo período têm o mesmo número de camadas eletrônicas, enquanto os elementos em um mesmo grupo (coluna) possuem propriedades químicas semelhantes, devido à configuração eletrônica similar dos seus elétrons de valência.
Períodos (linhas horizontais)
Organização: As linhas horizontais correspondem aos níveis de energia dos átomos. Cada período indica um novo nível de energia sendo preenchido por elétrons.
Propriedades: Elementos no mesmo período possuem diferentes números de camadas eletrônicas.
Exemplo: O Cálcio e o Potássio estão no período 4, o que significa que seus elétrons são distribuídos até a quarta camada de energia.
Grupos/Famílias (colunas verticais)
Organização: As colunas verticais agrupam elementos com propriedades físico-químicas semelhantes.
Propriedades: Elementos no mesmo grupo têm semelhanças nas suas configurações eletrônicas, como os elétrons de valência.
Exceção: O Hidrogênio, no Grupo 1, é uma exceção, pois não compartilha as mesmas propriedades que os outros elementos do grupo, como os metais alcalinos.
Nomes comuns: Alguns grupos têm nomes populares, como os Gases Nobres (Grupo 18), Metais Alcalinos (Grupo 1) e Halogênios (Grupo 17).
Blocos
Organização: A tabela também é dividida em quatro blocos (s, p, d e f) com base na subcamada eletrônica onde se encontram os elétrons mais externos.
Bloco s: Grupos 1 e 2.
Bloco p: Grupos 13 a 18.
Bloco d: Metais de transição (Grupos 3 a 12).
Bloco f: Lantanídeos e Actinídeos (localizados abaixo da tabela principal).
Quais são os 4 grupos da tabela periódica?
Os 4 blocos da tabela periódica são o bloco s, o bloco p, o bloco d e o bloco f. Esta classificação se baseia na configuração eletrônica dos elementos e se divide nos grupos 1 e 2 (bloco s), grupos 13 a 18 (bloco p), grupos 3 a 12 (bloco d), e as séries lantanídeos e actinídeos (bloco f).
Bloco s: Inclui os grupos 1 e 2, além do hidrogênio e do hélio.
Bloco p: Inclui os grupos 13 a 18.
Bloco d: Inclui os grupos 3 a 12, que são os metais de transição.
Bloco f: Inclui os lantanídeos e actinídeos, que geralmente ficam separados na parte inferior da tabela periódica.